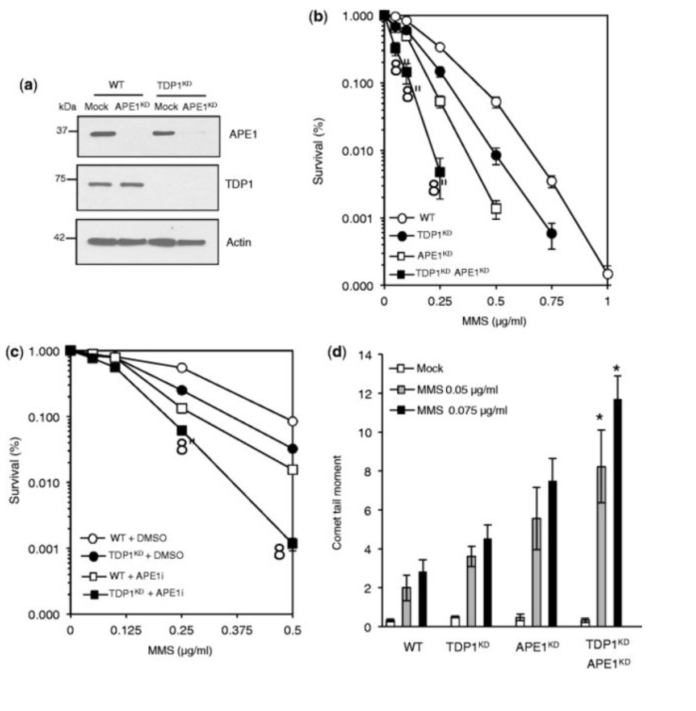
يعد الضرر الأساسي وانقطاع الحمض النووي المرتبط بتوبويزوميراز I (Top1) من الأشكال الوفيرة لكسر الحمض النووي الداخلي، مما يساهم في الرنح الوراثي ويسبب السمية الخلوية لمجموعة واسعة من العوامل المضادة للسرطان. وعلى الرغم من تكرارها، فإن الآليات المتداخلة التي تعمل على إصلاح هذه الأشكال من تكسر الحمض النووي غير معروفة إلى حد كبير. هنا ، نذكر أن استنفاد Tyrosyl DNA phosphodiesterase 1 (TDP1) يحسس الخلايا البشرية لتلف الألكلة وأن الاستنفاد الإضافي للنوكلياز الداخلي الأبورينيك / الأبيريميدين I (APE1) يمنح فرط الحساسية أعلى من تلك التي لوحظت في استنفاد TDP1 أو APE1 وحده. يؤكد القياس الكمي لفواصل الحمض النووي وفحوصات البقاء على قيد الحياة دور TDP1 في الاستجابة للضرر الأساسي، بشكل مستقل عن APE1. تتم استعادة فرط الحساسية لأضرار الألكلة جزئيًا عن طريق استنفاد Top1، مما يوضح أن عوامل الألكلة يمكن أن تؤدي إلى حدوث فواصل Top1 السامة للخلايا. على الرغم من أن تثبيط نشاط PARP لا يؤدي إلى توعية الخلايا التي تعاني من نقص TDP1 تجاه سموم Top1، إلا أنه يمنح حساسية متزايدة لأضرار الألكلة، مما يسلط الضوء على الأدوار المتداخلة جزئيًا لـ PARP وTDP1 استجابةً للتحدي السمي الجيني. أخيرًا، أثبتنا أن الخلايا السرطانية التي يكون فيها TDP1 ناقصًا بطبيعتها تكون شديدة الحساسية لأضرار الألكلة وأن استنفاد TDP1 يحسّس الخلايا السرطانية المقاومة للورم الأرومي الدبقي تجاه عامل الألكلة تيموزولوميد.
ألاجوز إم، ويلز أو إس، إل-الخميسي سادس (2013). يؤدي نقص TDP1 إلى تحسس الخلايا البشرية للضرر الأساسي من خلال آليات TOP1 وPARP المتميزة مع تطبيقات علاج السرطان. الأحماض النووية الدقة 1؛ 42(5): 3089-103.
أستاذ الطب الجزيئي، مدير الأبحاث والابتكار ومؤسس مشارك لمعهد Healthy Life Span، جامعة شيفيلد، المملكة المتحدة
شريف الخميسي هو محقق في مؤسسة Wellcome Trust والمؤسس المشارك لـ معهد الحياة الصحية بجامعة شيفيلد. يدرس معمل الخميسي كيفية محافظة الخلايا على السلامة الجينية وتأثيرها على الصحة. يستخدم المختبر نهجًا متعدد التخصصات يدمج علم الوراثة والكيمياء والبيولوجيا مع الخبرة السريرية. نحن نستخدم نماذج الماوس والزرد للحفاظ على الشيخوخة والمراضة المتعددة على المستوى الجزيئي والعضوي. نحن نربط فهمنا الجزيئي بتحديات الصحة العامة من خلال التفاعل مع علماء الاجتماع.